Concombre, melon : la sexualité dévoilée
Jardins de France


La grande majorité des végétaux sont hermaphrodites, c’est-à-dire que leurs fleurs renferment à la fois des organes mâles et femelles. Cependant, certaines espèces ont des fleurs de sexe séparé, soit sur la même plante (monoïque), soit sur des plantes différentes (dioïque) qui sont donc des espèces modèles pour l’étude du déterminisme sexuel chez les plantes. C’est le cas de la famille des Cucurbitacées qui rassemble entre autres pastèque, melon, concombre, courgette…
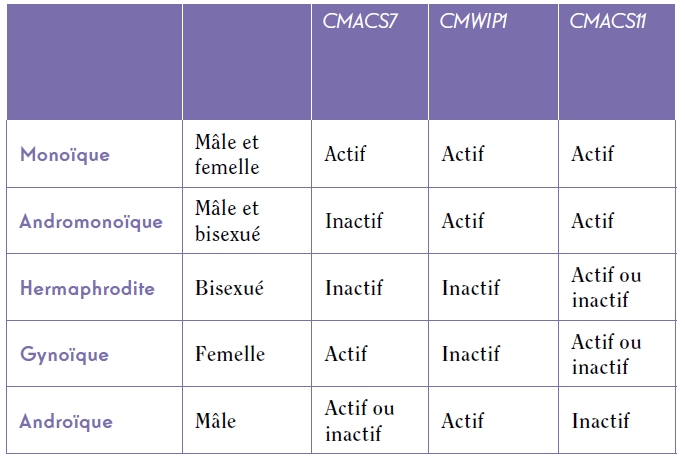
Chez le melon et le concombre, la plupart des variétés cultivées sont principalement monoïques (présence de fleurs mâles et de fleurs femelles sur une même plante) ou andromonoïques (fleurs mâles et fleurs hermaphrodites sur une même plante). Plus minoritairement, les plantes peuvent également être gynoïques (uniquement des fleurs femelles) ou hermaphrodites (uniquement des fleurs hermaphrodites)[2].
Gênes identifiés
En 2008, le gène impliqué chez le melon dans le contrôle de la formation des organes mâles dans les fleurs pistillées (avec un appareil reproducteur femelle) a été identifié. L’expression de ce gène CmACS7[3] inhibe le développement des étamines (appareil reproducteur mâle des fleurs) dans les fleurs qui sont potentiellement bisexuées, entraînant ainsi le développement d’une fleur femelle. Lorsque ce gène est muté et l’enzyme inactive, alors les fleurs femelles deviennent hermaphrodites. Ce gène n’est pas nécessaire dans le développement des carpelles (appareil reproducteur femelle). Puis, en 2009, c’est au tour du gène impliqué dans le contrôle de la formation des organes femelles d’être mis en évidence toujours chez le melon. Baptisé CmWIP1, son expression inhibe le développement des carpelles entraînant alors le développement d’une fleur mâle. Lorsque ce gène est muté, la plante de melon n’a plus de fleurs uniquement mâles : elle est soit gynoïque, soit hermaphrodite. De plus le gène CmWIP1 interagit avec CmACS7 : lorsqu’il est actif il inhibe l’expression de CmACS7 et lorsqu’il est inactif le gène CmACS7 peut s’exprimer et inhiber le développement des étamines. Enfin la non-expression du gène CmWIP1 n’est pas due à une mutation dans le gène lui-même mais est liée à l’insertion d’un transposon à proximité du promoteur du gène CmWIP1 qui empêche son expression.
Ainsi, les chercheurs ont démontré que la combinaison de ces deux éléments génétiques CmACS7 et CmWIP1 contrôle le développement floral aboutissant aux quatre phénotypes sexuels chez le melon et le concombre et potentiellement chez un large éventail d’espèces dicotylédones.
Un modèle d’évolution du sexe
Dans ce modèle génétique, il restait à comprendre comment les plantes dioïques (fleurs mâles et femelles sur des pieds séparés) parviennent à se développer. Il existe des accessions de concombre androïques c’est-à-dire n’ayant que des fleurs mâles. Le gène contrôlant ce caractère a été identifié comme faisant partie de la famille ACS. Il a également été caractérisé dans une population mutante de melon et dénommé CmACS11. Les chercheurs de l’INRA ont découvert que si le gène CmWIP1 permet l’expression de fleurs mâles dans les tiges principales, le gène CmASC11 inhibe l’expression de CmWIP1 au niveau des ramifications de la plante et y entraîne le développement de fleurs femelles. Lorsque le gène CmASC11 ne s’exprime pas et que CmWIP1 est exprimé, on observe alors le développement de fleurs mâles uniquement sur l’ensemble de la plante. En déchiffrant ce mécanisme génétique, ils ont créé artificiellement des espèces dioïques ce qui leur a permis de proposer un modèle d’évolution du sexe chez les plantes qui va des espèces hermaphrodites aux dioïques en passant par le stade intermédiaire des espèces monoïques.
Applications agronomiques considérables
Outre des avancées notables dans la connaissance fondamentale des mécanismes de floraison, ces résultats laissent entrevoir des applications agronomiques considérables.
La création de lignées pures et stables qui seront les futurs parents d’une plante hybride commerciale est une condition nécessaire pour créer des variétés hybrides homogènes et reproductibles exprimant un haut niveau d’hétérosis. La production, à partir de ces lignées pures d’hybrides cumulant les caractères de qualité, de résistance aux maladies, de productivité, de régularité de rendement, etc., nécessite d’empêcher complètement l’autopollinisation.
Actuellement, diverses approches génétiques, chimiques et mécaniques sont utilisées pour contrôler l’autopollinisation ou supprimer les fleurs mâles (création d’une stérilité mâle transitoire), mais elles restent limitées par des facteurs de coût, d’efficacité, de durée d’action ou des effets phytotoxiques.
La mise en pratique des résultats présentés : obtention de plantes d’un type sexuel déterminé devrait permettre de résoudre ces difficultés. Par ailleurs, la production plus importante de plantes femelles (à l’origine de la formation des fruits) permettrait d’améliorer les rendements.
Les publications de l’Equipe de Recherche d’Abdel Bendahmane (Dir de Recherche à l’INRA) dont nous avons rapporté les découvertes.
Martin A, Troadec C, Boualem A, Rajab M, Fernandez R, Morin H, Pitrat M, Dogimont C, Bendahmane A., A transposon-induced epigenetic change leads to sex determination in melon, Nature. 2009;461(7267):1135-8
Boualem A, Troadec C, Kovalski I, Sari MA, Perl-Treves R, Bendahmane A., A conserved ethylene biosynthesis enzyme leads to andromonoecy in two Cucumis species, PLoS One. 2009 4(7) : e6144
Boualem A, Fergany M, Fernandez R, Troadec C, Martin A, Morin H, Sari MA, Collin F, Flowers JM, Pitrat M, Purugganan MD, Dogimont C, Bendahmane A., A conserved mutation in an ethylene biosynthesis enzyme leads to andromonoecy in melons, Science. 2008, 321(5890):836-8
Boualem A, Troadec C, Camps C, Lemhemdi A, Morin H, Sari MA, Fraenkel-Zagouri R, Kovalski I, Dogimont C, Perl-Treves R, Bendahmane A. A cucurbit androecy gene reveals how unisexual flowers develop and dioecy emerges. Science, 2015,350 (6261) : 688-694
[1] D’après : « Combinaison de 2 gènes contrôlant le phénotype sexuel floral des plantes, http://www.inra.fr/Entreprises-Monde-agricole/Offres-de-technologie/Toutes-les-actualites/phenotype-sexuel-floral-des-plantes »
« La sexualité des cucurbitacées dévoilée, http://presse.inra.fr/Ressources/Communiques-de-presse/sexualite-des-cucurbitacees »
[2] Voir Cucurbitacées : une sexualité complexe et variée par M. Pitrat, jardins de France (642)
[3] On notera que l’enzyme ACS (1-aminocyclopropane-1-carboxylic acid synthase) est l’avant-dernière enzyme dans la voie de biosynthèse de l’éthylène chez les plantes. Voir aussi l’article de la note 1 pour l’effet de ce régulateur sur la sexualité des Cucurbitacées
