Les conifères, une famille à évolution complexe
Pauline Bouché
Les plantes à « graines nues » que sont les gymnospermes font partie de la lignée des plantes à graines, au même titre que les angiospermes. Mais de nombreuses différences les distinguent. Souvent considérés comme des végétaux fossiles, les gymnospermes offrent des caractéristiques très intéressantes comme la résistance à la sécheresse. Maximilien Larter et Pauline Bouché nous font entrer dans les dédales de la grande famille des conifères ou plutôt ce groupe composé de sept familles. Mais ce n’est pas qu’un jeu !
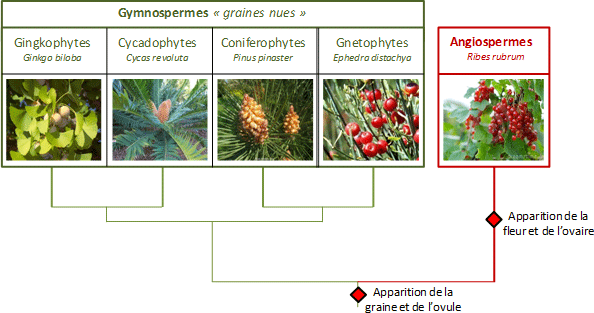
Arbre décrivant les relations entre les groupes de plantes à graines (Spermaphytes). A noter que la position des Cycadophytes et des Gnétophytes (tirées ici de la littérature) est encore débattu entre phylogénéticiens et taxonomistes.
Des aiguilles, des écailles, des cônes, et des trachéides
Si les gymnospermes (Gingkophytes, Coniferophytes, Gnetophytes et Cycadophytes) et les angiospermes appartiennent à la lignée des plantes à graines (spermaphytes) ils n’en sont pas moins radicalement différents. En effet, les gymnospermes ou littéralement « plantes à graines nues » ne présentent pas de fleur ni de fruit comme les angiospermes, mais des cônes ouverts laissant les ovules et graines qu’ils portent exposées à l’air libre (fig. 1). Si l’on s’attarde sur l’anatomie plus « profonde » de ces plantes on constate que leur système hydraulique, appelé xylème (tuyau qui transporte la sève) est constitué uniquement de trachéides contrairement aux angiospermes dont le xylème comprend à la fois des trachéides et des vaisseaux.
Bien que les critères de distinctions Angiospermes-Gymnospermes semblent clairs, il existe cependant une discordance à propos de l’appartenance des Gnétophytes à la lignée des Gymnospermes – ce sont par exemple Welwischia mirabilis (désert de Namibie), Ephedra distachya (le Raisin de mer, commun sur les côtes atlantiques françaises) ou encore Gnetum nodiflorum (Amérique du Sud). En effet, les Gnétophytes présentent des ressemblances morphologiques avec les Angiospermes telles que la présence de « pseudo fruit ». Autre chose surprenante, le xylème des Gnétophytes est composé de trachéides et de vaisseaux, comme les angiospermes… Sur ces critères morphologiques, nos Gnétophytes seraient donc plus apparentés aux Angiospermes. Mais des analyses moléculaires (voir encadré 1) semblent indiquer que les Gnétophytes seraient un groupe frère des Conifèrophytes confirmant ainsi leur appartenance aux Gymnospermes (fig. 1). Alors d’où viennent ces ressemblances avec les angiospermes ? Il semble que cela résulteraient d’une convergence évolutive de ces deux groupes, c'est-à-dire l’apparition indépendante (dans différentes lignées) de caractères similaires. On cite souvent comme exemple l’évolution des ailes chez les oiseaux et les chauves-souris : ces lignées éloignées (respectivement au sein des dinosaures et des mammifères) ont développé à environ 100 millions d’années d’écart une capacité de vol similaire !
Le grand groupe des conifères
Les relations entre les 7 familles de conifères sont désormais bien connues (fig. 2). La famille des Pinaceae (pin, cèdre, mélèze, sapin) occupe une position basale par rapport à toutes les autres familles (c’est la lignée la plus ancienne). Vient ensuite la séparation des Araucariaceae (Araucaria araucana, le désespoir du singe) et des Podocarpaceae (grande famille d’espèces tropicales de l’hémisphère sud, bien souvent à « feuilles » larges). A noter que certains auteurs insèrent une famille supplémentaire au sein de cette dernière famille, les Phyllocladaceae (contenant les 5 espèces du genre Phyllocladus – originaires des îles d’Asie du Sud-est). Ces espèces sont caractérisés notamment par des excroissances de tige ressemblant (mais d’origine différente) à des feuilles, ce qui justifie selon certains auteurs leur positionnement dans une famille à part. Une seule espèce appartient à la famille des Sciadopityaceae, Sciadopitys verticillata (le pin parasol du Japon). Les familles Cephalotaxaceae et Taxaceae (les ifs) sont très proches et sont parfois regroupées, et vient enfin la grande famille des Cupressaceae (cyprès, genévrier, thuya, séquoia), seule famille que l’on retrouve dans les deux hémisphères.
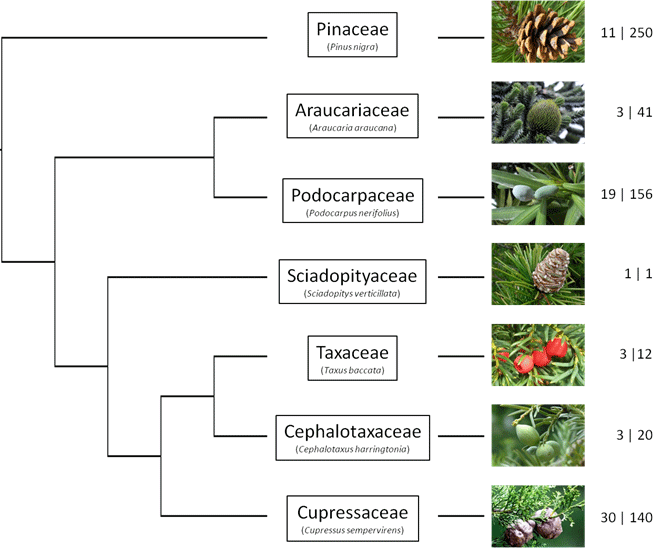
Arbre phylogénétique décrivant les relations entre les 7 familles de conifères. Pour chaque famille un exemple d’espèce typique est donné (en photo) ainsi que leur importance (nombre de genres | nombre d’espèces).
Evolution à une échelle géologique
L’incorporation d’informations tirées de fossiles de plantes dans les phylogénies moléculaires permet d’y ajouter un cadre temporel. On sait par exemple que les premiers fossiles de gymnospermes apparaissent vers la fin du Carbonifère, il y a entre 300 et 310 millions d’années ; ou encore que les premiers cônes typiques de la famille des pins (Pinaceae) sont apparus il y a 225 millions d’années. Différentes méthodes ont été élaborées pour mêler ces « calibrations fossiles » et des données moléculaires pour définir des phylogénies dans lesquelles les branches représentent le temps (généralement en millions d’années). Ceci a permis récemment d’apporter de nouvelles connaissances sur l’évolution de différents groupes des plantes.
Le terme de « fossile vivant » décrit un organisme dont la lignée évolutive est ancienne (présence de fossiles de plusieurs dizaines voire centaines de millions d’années) et dont la morphologie actuelle est similaire à ses ancêtres fossilisés. Le cœlacanthe est probablement l’exemple le plus connu de « fossile vivant » : cette espèce de poisson était considérée éteinte avant d’être découverte au milieu du XXe siècle dans l’Océan Indien et sa morphologie n’aurait pas évolué en près de 400 millions d’années. Chez les plantes, le Ginkgo, les Cycas, et certains conifères (comme le Wollemia lien vers l’article sur le Wollemia) ont souvent été qualifiés de « fossiles vivants ». De récentes études moléculaires viennent toutefois contredire ces certitudes.
La lignée des Cycadophytes est ancienne, ayant atteint un niveau maximal de diversité et de dominance durant le Crétacé et le Jurassique (199,6 à 65,5 M d’années). Cependant, Nagalingum et al. (2011) ont construit une phylogénie de 199 espèces (sur environ 300) pour ce groupe de plantes, et ont montré que les genres importants (Cycas, Encephalartos, Zamia, Macrozamia et Ceratozamia) ont subi une diversification rapide et récente, il y a environ 10 M d’années. Les auteurs indiquent que l’émergence des climats modernes vers la fin du Miocène (il y a 5 à 10 M d’années), avec de larges régions tropicales et subtropicales à saison des pluies très marquées pourrait expliquer cette radiation[1].
Des résultats similaires ont été publiés récemment chez les conifères. Leslie et al. (2012) ont étudié près de 500 espèces de conifères, et ont montré une diversification récente au cours des 20 derniers millions d’années. Leurs résultats sont d’autant plus intéressants qu’ils montrent que les groupes d’hémisphère nord (Pinaceae, et la sous-famille des Cupressoideae) seraient d’origine plus récente (< 5 M d’années) que des groupes d’hémisphère Sud (Araucariaceae, Podocarpaceae, et la sous-famille des Callitroideae - entre 5 et 17 M d’années). Ils émettent l’hypothèse que ces différences seraient liées aux cycles de glaciations qui auraient marqué l’hémisphère Nord entraînant l’évolution des plantes pour s’adapter aux changements climatiques.
[1] Diversification plus ou moins rapide d’une lignée, avec notamment une multiplication du nombre d’espèces, l’apparition d’une grande diversité morphologique et l’occupation de nombreux habitats (par exemple la radiation des mammifères à la fin du Crétacé).
Et en termes de résistance à la sécheresse…
De manière générale, des études ont montré que les conifères sont plus résistants à la sécheresse que les angiospermes (Maherali et al. 2004). La question qui se pose alors est : quels sont les mécanismes anatomiques et physiologiques à la disposition des arbres pour résister au manque d’eau ? Lors de sécheresses intenses, des bulles d’air se propagent dans les éléments conducteurs du xylème empêchant ainsi le transport de l’eau des racines jusqu’aux feuilles de façon similaire à une embolie pulmonaire. Ce mécanisme appelé cavitation provoque un dysfonctionnement du transport hydrique et peut, à terme, conduire à la mort des organes et de l’arbre. Si l’on observe l’anatomie fine du système de transport de l’eau (le xylème), on constate que l’eau circule à travers des structures poreuses présentes dans la paroi des éléments conducteurs du xylème appelées « ponctuations » (fig. 3). Chez les espèces à vaisseaux, comme les angiospermes, elles sont constituées uniquement d’un réseau de tresses (microfibrilles) formant une membrane poreuse (fig. 3 – A). Celles des conifères, plus complexes, présentent un épaississement (torus) au centre de la membrane de microfibrilles formant une barrière plus efficace contre le passage de l’air (fig. 3 - B). Lorsqu’un conduit est rempli d’air, le torus agit comme une valve : il est aspiré par l’eau contre la paroi de la trachéide fonctionnelle, et empêche le passage de l’air (fig. 3 – d).

Figure 3 : A. Coupe longitudinale (a) et transversale (b) d’une ponctuation chez les angiospermes avec présence d’une membrane de microfibrilles. B. Coupe longitudinale (c) et transversale (d) d’une ponctuation chez les Conifères avec un torus au centre de la membrane de microfibrilles.
Cette structure très sophistiquée de « sécurité hydraulique » qu’est le torus est apparue chez les gymnospermes modernes (Ginkgo, Gnétales et Conifères) mais est absente chez leurs cousins les Cycadophytes. De manière indépendante, dans des phénomènes d’évolution convergente, 8 genres de 5 familles éloignées d’Angiospermes ont également développés un torus. Des chercheurs bordelais examinent actuellement la résistance à la sécheresse dans des lignées avec et sans torus, pour examiner son rôle dans la protection contre l’embolie dans le système conducteur de la plante.
Afin de caractériser la résistance à la cavitation d’une espèce, les chercheurs utilisent une courbe de vulnérabilité qui correspond à l’évolution du taux d’embolie (cavitation) avec l’augmentation de la sècheresse. Pour cela des branches sont laissées sur la paillasse au laboratoire pendant plusieurs heures pour obtenir différents niveaux de sècheresse. A chaque niveau, le degré d’embolie est mesuré. Ces courbes permettent de déterminer la pression négative[2] qui induit 50% d’embolie dans la branche, aussi appelé P50. Ce paramètre permet ainsi de comparer la résistance à la sécheresse des espèces. Nous savons par ailleurs, que ce seuil de 50% induit la mort des conifères lorsqu’il est atteint en milieu naturel. Pour les valeurs proches de 0 (faiblement négatives, entre -1 et -4 MPa) l’espèce est jugée peu résistante, et à l’inverse à partir de -7 MPa, l’espèce peut tolérer des sécheresses importantes. A titre d’exemple, le cyprès chauve (Taxodium) est l’une des espèces les moins résistantes du monde (P50=-2,3 MPa) alors que le record absolue a été mesuré chez une espèce semi-désertique australienne (Callitris columellaris, P50=-16 MPa, Delzon et al. 2010, Brodribb et al. 2010).
Pittermann et al. (2012) ont étudié la résistance à la cavitation chez une vingtaine d’espèces de conifères de la famille des Cupressaceae. L’utilisation d’une phylogénie (fig. 4) leur a permis de découvrir que les espèces résistantes à la cavitation sont apparues dans deux groupes séparés géographiquement, les Callitroideae (hémisphère Sud) et les Cupressoideae (hémisphère Nord), et semble coïncider avec l’apparition de milieux plus arides à la fin de l’Eocène (il y a environ 35 M d’années). Cette adaptation coïncide (i) avec l’évolution des aiguilles en écailles chez ces espèces (principalement Callitris, Cupressus et Juniperus) (ii) et une diversification de ces groupes avec un plus grand nombre d’espèces.
A l’opposé, dans la famille des Pinaceae, on observe une stase évolutive, c'est-à-dire que toutes les lignées ont maintenu une faible résistance à la cavitation. Cela peut sembler surprenant puisque ce groupe couvre une large gamme climatique, allant du bassin méditerranéen (Cedrus libani) au cercle polaire (Larix gmelinii), et des dunes côtières (Pinus pinaster) aux sommets des montagnes (Pinus hartwegii, l’arbre le plus haut du monde, vivant à plus de 4300 m d’altitude au Mexique). De plus au sein d’une même espèce, comme par exemple chez le pin maritime, les populations d’environnement très sec (Maroc – moins de 500 mm de pluie par an) et plutôt humide (Sud Ouest de la France – jusqu’à 1200 mm) présentent une résistance à la sécheresse similaire (Lamy et al. 2011). D’après cette étude, la résistance à la cavitation chez le pin maritime serait « canalisée » : des mécanismes génétiques limiteraient l’effet de nouvelles mutations, maintenant ainsi une résistance identique chez tous les individus provenant pourtant de climats très différents. A l’échelle des Conifères, il semble donc que certaines lignées (notamment au sein des Cupressaceae) ont pu se défaire de ces contraintes évolutives. Une équipe de chercheurs européens essaie actuellement d’établir quelles modifications ont permis de lever ces contraintes, en particulier au niveau de l’anatomie du xylème. La compréhension de ces mécanismes évolutifs est essentielle pour prévoir par exemple, la capacité d’adaptation des espèces et donc l’effet du changement climatique sur les écosystèmes forestiers dans les décennies à venir.
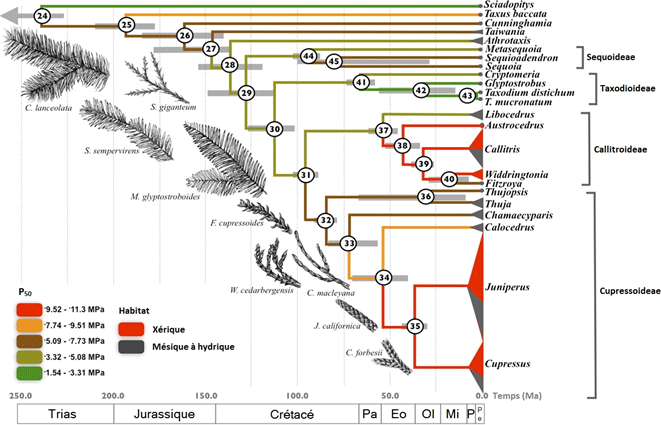
Figure 4 : Phylogénie de la famille des Cupressaceae (tirée de Pittermann et al. 2012) décrivant l’évolution de la résistance à la cavitation au sein de cette famille. La couleur des branches représente la résistance à la cavitation (en rouge les espèces résistantes, et en vert les espèces vulnérables). Les expansions aux extrémités de l’arbre indiquent le nombre d’espèces dans chaque genre, et leur couleur correspond à l’habitat des espèces (en rouge pour les milieux arides, et en gris pour les milieux plus humides) et des exemples de type de feuillages de quelques espèces sont donnés. (Pa = Paléocène, Eo=Eocène, Ol = Oligocène, Mi = Miocène, P = Pliocène, Pe = Pléistocène).
[2] « Aspirée » à partir des feuilles, l’eau dans la plante circule sous tension (pression négative - phénomène similaire à l'aspiration de l'eau dans un verre avec une paille) : plus le sol est sec ou plus le climat est chaud, plus la plante doit « aspirer » fort pour extraire de l’eau du sol, et donc plus la « pression » dans le xylème est négative !
